药物杂质来源于药物生产储存的各个环节,从药物的起始原料-合成过程-原料药-辅料或赋形剂-药物制剂-药包材-药物储存,均有可能产生药物杂质。
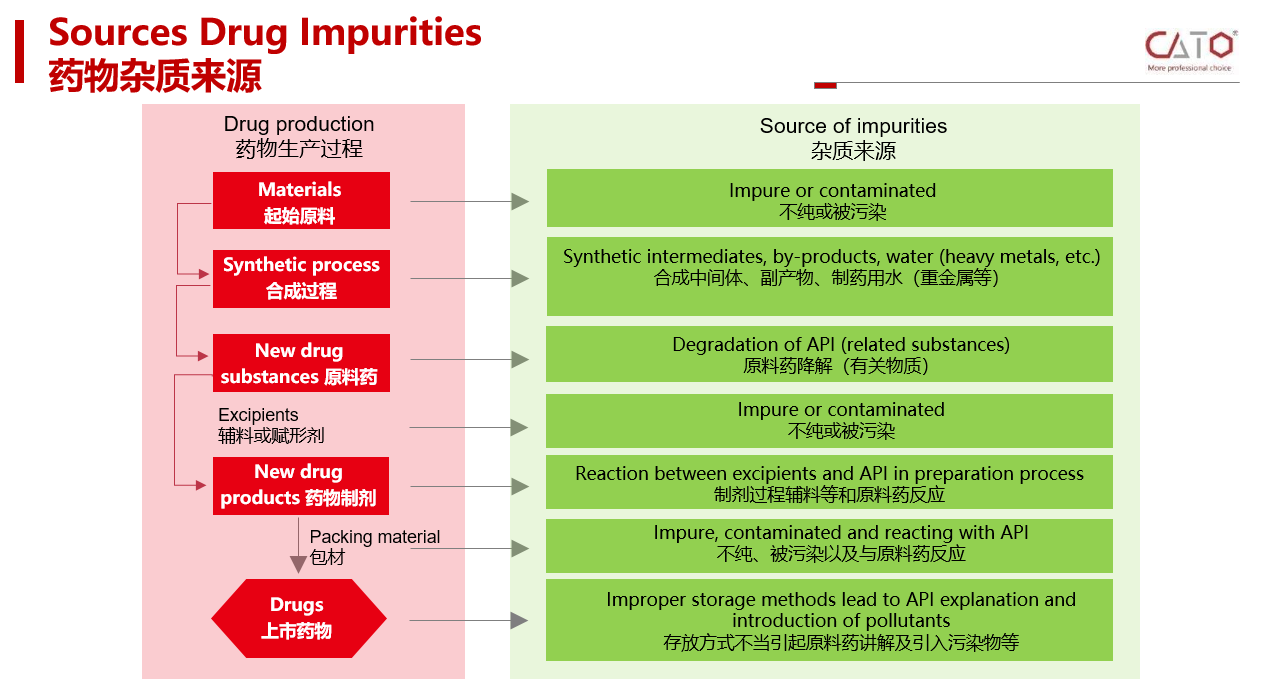
按照来源,药物杂质分为:工艺杂质 (包括合成中未反应完全的反应物及试剂、中间体、副产物等)、降解产物、从反应物及试剂中混入的杂质等药物杂质;
按照理化性质,药物杂质分为: 有机杂质、无机杂质及残留溶剂;
按照毒性分类,药物杂质分为毒性杂质和普通杂质等;
按照化学结构分类,药物杂质可分为:其它甾体、其它生物碱、几何异构体、光学异构体和聚合物等。
在《化学药物杂质研究的技术指导原则》中,指出:任何影响药物纯度的物质统称为杂质。
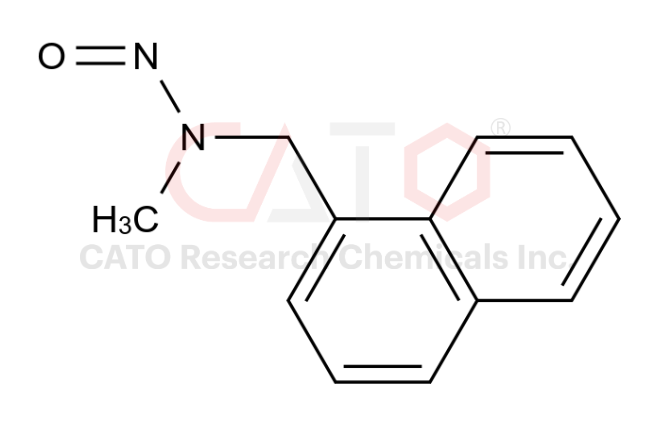
药物杂质往往会影响药物主成分的药用效果,甚至于产生毒副作用。大名鼎鼎的基因毒性杂质,便是药物杂质的其中一种,长期服用含有超剂量基因毒性杂质药物的患者,具有很大的患癌风险。因此,药物杂质研究是药物质量研究过程中极其重要的一环。随着国家对一致性评价工作的开展和推进,药物杂质研究已成为CFDA药品评审重要的一项指标、要求和技术门槛。
药物杂质来源于药物生产储存的各个环节,从药物的起始原料-合成过程-原料药-辅料或赋形剂-药物制剂-药包材-药物储存,均有可能产生药物杂质。

按照来源,药物杂质分为:工艺杂质 (包括合成中未反应完全的反应物及试剂、中间体、副产物等)、降解产物、从反应物及试剂中混入的杂质等药物杂质;

按照理化性质,药物杂质分为: 有机杂质、无机杂质及残留溶剂;
按照毒性分类,药物杂质分为毒性杂质和普通杂质等;
按照化学结构分类,药物杂质可分为:其它甾体、其它生物碱、几何异构体、光学异构体和聚合物等。
药物杂质的质控标准主要有:ICH Q3A(R):New drug substances和ICH Q3B(R):New drug products 两项,分别明确了原料药及制剂产品的药物杂质质控标准。

光谱检验方式
光谱检验方法是利用药品主成分和药物杂质之间的光学性质差异而进行检测的方法,光谱法可以借助有关的参数对药物杂质进行检测。主要的光谱检验方法有紫外-可见分光光度法、红外分光光度法、原子吸收分光光度法、核磁共振质谱法和热分析法等,这些方法各有特点。
紫外分光光度法具有较高的灵敏度,操作相对简单,重现性好,操作仪器也得到了很好地普及。
红外分光光度法主要用在检查药物的有效性上,非常适用于某些多晶型药物的杂质检测譬如能将甲苯咪唑中的A晶型检测出来。
原子吸收分光光度法是一种灵敏度很高的测定方法,广泛用于微量金属元素的分析,最重要是检查药物中的金属杂质;在检查特殊杂质结构的过程中则采用核磁共振谱方式。
热分析法广泛应用于药物的多晶型、物相转化、结晶水,结晶溶剂、纯度、热稳定性,以及基于相容性的固体分散系统、脂质体、药物辅料相互作用(预测药物与赋形剂间的可配伍性)等的研究。
色谱检验方式
色谱检测方式主要是将药物主成分及药物杂质之间的色谱关系进行比较,将其中所含的特殊杂质成分检查出来。色谱检验方式主要包括纸色谱法、薄层色谱法、气象色谱法、高效液相色谱法以及超临界流体色谱法。
纸色谱法通常用于极性较大的药物或放射性药物的检查。该法展开时间长、斑点较为扩散、不能用强酸等腐蚀性显色剂。
薄层色谱法主要是用于检查双氢青蒿素中所含有的药物杂质,这种检测方式操作相对简单,应用也比较便捷,其不需要借助特别昂贵的仪器设备。例如:采用薄层扫描方式检查光谱消毒杀菌剂中的氯苯胺。分离效果高、快速、便捷是其主要的特点,可以作为高效液相色谱的辅助检查方式,进行无紫外吸收。
气相色谱法是采用气体为流动相(载气)流经装有填充剂的色谱柱,进行分离测定的色谱方法。物质或其衍生物气化后,被载气带入色谱柱进行分离,各组分先后进入检测器,用数据处理系统记录色谱信号。利用气相色谱方式可以检查盐酸美金刚胺中的特殊杂质。因为气相色谱方式主要需要样品气化,这种检测方式受到挥发性的限制,主要检查挥发性杂质或者药物生产时所具有的有害有机溶剂残留总量,其中主要包括苯、二氯甲烷、二氧六环以及甲苯等物质。
高效液相色谱法是药物杂质检查的主要方式,分离效能高、专属性强和检测灵敏,适用于有机杂质,但更多地用于含量测定。按照药物以及特殊杂质的性质差异性进行划分,高效液相色谱法可以划分为几种类型。其主要包括反相高效液相色谱法、正相高效液相色谱法、离子抑制高效液相色谱法。反相高效液相色谱法用于检查硫酸新霉素中的药物杂质,离子抑制高效液相色谱法用于检测唬乙红霉素中的药物杂质。除此之外,在药物对映体的拆分中还可以应用高效液相色谱法,又被称为手性色谱法。由于手性药物的药物作用、毒副作用以及分子立体结构形状之间具有较大的联系性,所以还需要检查映体的纯度,确保药物的作用,从而降低毒副作用。高效液相色谱法还能提供痕量水平测定过程中所需要的灵敏度,能将特殊杂质的总量检测出来,同时还能将一些特殊杂质的含量检测出来。这种检测方式是用于药物杂质检测的主要方式。
超临界流体色谱法,被广泛用于天然物、药物、表面活性剂等物质的药物杂质分析中,采用超临界流体SF作为流动相,具有检测方式和固定相种类多样的特点,较好地弥补了高效液相色谱和气相色谱的不足。
由于药物杂质的种类较多,而且产生于药物制造到上市的各个环节,因此控制策略和控制方法相应多种多样。根据质量源于设计的理念,杂质控制点可分为源头控制、过程控制、终点控制。控制方法有多种,例如性状、晶型、熔点、比旋度、异构体、有关物质、残留溶剂、氯化物、硫酸盐、pH值、溶液颜色和澄清度、炽灼残渣、重金属、元素杂质、基因毒性杂质等。
源头控制
1、起始原料
对起始原料进行质量控制可以从以下方面考虑:
(1)根据ICH Q11,严格筛选并确定起始原料(外购或自行生产),确定合成路线
(2)所确定的起始原料生产工艺应稳定,规模可以满足原料药的商业生产需要
(3)对所确定的起始原料生产商进行供应商审计(外购情况),生产商应有良好的生产、质量控制体系。获得供应商起始物料的生产工艺,结合自身工艺特点,分析起始物料的关键质量属性,特别是起始物料及其杂质在后续工艺中,是否去除或者转化,从而针对性的建立起始物料的内控质量标准。
(4)根据原料药的合成工艺,API分子结构,相关EMA审评报告,IF文件和化学机理分析初步确定降解杂质。
(5)原料药生产厂家应根据所确定的起始原料的生产工艺,对其杂质(起始原料、中间体、副产物、试剂、毒性杂质、残留溶剂、金属杂质)进行全面的汇总分析,建立分析方法进行质量评估。这其中要经历方法建立、方法学验证、方法转移等阶段。最后还要将新建立的方法与厂家方法进行多批次的数据对比,证明方法是否可行。
2、辅料
在制剂的开发阶段,应进行不同供应商、不同级别、粒度、酸碱度等辅料的对比研究工作,根据相容性、稳定性、工艺可行性等结果确定合适的供应商,并制定针对这个特定品种的辅料内控标准,有效保证产品质量。
过程控制
1、生产过程控制
应避免选择可能产生遗传毒性杂质的工艺。对于原料药合成过程中用到的各种有机试剂、无机试剂、催化剂等,应对其进行来源和去向分析,要建立分析方法进行检测,积累数据,制定合理的控制策略。有些杂质的控制策略未包括在质量标准中,但已经内含在工艺当中了,如精制步骤的顺序、试剂加入顺序、加料速度、搅拌方式、搅拌速度、降温时间、pH、干燥时间等。
对于手性药物而言,在研究与制备过程中需要随时关注与控制其光学纯度。在有的原料药合成工艺中,如果从工艺中对产品的光学纯度进行了有效的全程控制,就能从根本上控制终产品的质量。
对于制剂生产过程中由于光照、氧化、水解作用等产生的杂质,应结合工艺进行分析和控制,控制方法和参数应根据大生产规模下确定的工艺参数进行确定,并能够保证方法有效、可重现。
2、中间体控制
对于中间体和副产物等杂质,应充分体现过程控制的理念。对于关键中间体,如果不同规模、多批次的检测结果表明存在起始原料、副产物或降解产物,这些杂质含量较大或可能对下一步反应存在影响,那么,应在中间体质量标准中对其进行详细研究和控制,HPLC法是首选方法。
必要时,对敏感因素(如光、温度、水分、氧等)应选择恰当的包装材料、规定合理的贮藏条件进行控制,采用如黑色袋密封、铝桶包装、充氮、冷藏保存等。可根据中间体的稳定性考察结果,制定中间体的保存条件和保存期限。
如果中间产品不能够满足所制定的质量标准,有时也可根据前期的研究结果,选择可行的再处理方法对中间产品进行再处理使其满足质量标准,但这些特殊情况应在申报资料中进行说明。
终点控制
终点控制是指在终产品(原料药、制剂)中进行控制。通常,在终产品中进行杂质控制就是要制定一个或多个合理可行的杂质检查方法和限度。
1、原料药
原料药杂质检查方法的建立需要在全面杂质谱分析的基础上进行,例如有机杂质、无机杂质、残留溶剂、金属杂质,方法研究中需要考察方法的检出能力(重点是分离度、灵敏度),CDE往往要求采用已知杂质对照品进行方法研究与方法学验证。不同工艺生产的原料药,起始原料、中间体、副产物、残留溶剂可能是不同的,但是降解杂质应该是一样的,因此要结合国内外药典、文献、审评报告等进行降解杂质的分析,对比已有标准中的方法,考察对于降解杂质的检测能力。
对于毒性杂质(含亚硝胺类杂质),应根据国内外官方方法并采用官方规定(或推荐)限度进行研究(如LC-MS-MS/LC-MS法)。
无机杂质除了要进行药典规定的常规检查(炽灼残渣、重金属等)外,还要参考ICH Q3D或今后的2020版药典《元素杂质限度和测定指导原则》根据金属杂质的风险级别和分类管理结合制剂的暴露量合理制定元素杂质的限度。
对于注射级原料药中由生产工艺中引入或贮存中不稳定而产生的杂质或有色杂质,可采用溶液澄清度和溶液颜色检查法对其进行控制,控制方法详见药典相关通则。
对于一致性评价中的原料药内控标准建立或原料药仿制申报而言,应将已有标准和国内外最新版的药典方法(如ChP、USP、BP、EP、JP等)进行对比,选择相对较严格的或合理的限度进行杂质控制。对于没有国内外药典标准的原料药而言,应关注申报标准中项目设置的全面性和杂质限度的合理性,此时可以查找FDA、EMA、日本IF文件等审评资料,参考其中的规定进行研究和控制。
2、制剂
制剂应重点控制的是降解杂质,原则上对于已在原料药中控制(除了毒性杂质外)且在制剂生产及贮存过程中含量没有增加的工艺杂质,制剂中一般可不再控制(在计算降解产物总量时,也可以不将其计算在内)。此处的降解杂质主要是指加速试验、长期试验或实际贮藏过程中出现的原料药降解杂质。此外,制剂工艺过程中残留/新产生的、原料药与辅料(或辅料中的杂质)相互作用而产生的、制剂使用过程中产生的、制剂中存在的毒性杂质等也应该进行研究或控制。对于异构体杂质,在稳定性试验中也应进行研究,一方面考察药物在各种环境因素下以及放置过程中是否稳定,是否有外消旋化现象;一方面为质量标准的制定提供必要的依据。制剂杂质控制中最常见的方法为HPLC法、UPLC法、手性HPLC法、离子色谱法等。
持续改进
一个原料药或制剂被批准上市以后,质量标准往往不是一成不变的,如EP、USP、ChP标准就经常升级更新,更新后的标准中所控制的杂质种类、方法、限度有时会之前完全不同。因此,一个品种的杂质控制有时也是一个持续改进的过程。
产品在批准上市后,往往会有各种“变化”出现,例如原料药工艺的变更、辅料厂家或辅料生产工艺的变化、制剂生产工艺参数的变化等,这些变化有时会引起产品中杂质种类和量上的变化。这时应结合变更情况并参考最新版药典质量标准开展变更研究,重新考虑杂质控制,不断提高产品质量。