自2018年在某些降压药中首次被发现以来,各国监管机构,特别是欧洲药品管理局(EMA)和美国食品药品监督管理局(FDA),相继出台了严格的指导原则,以控制药品中的亚硝胺杂质水平。这些指导原则涵盖了亚硝胺杂质的种类、可接受摄入量限值、检测方法以及风险评估策略等方面。

本文将比较EMA与FDA在亚硝胺杂质监管方面的主要差异,并重点关注FDA近期对道古霉素(Dalbavancin,中文又称“达巴万星”)相关亚硝胺指导原则的更新。
在深入比较EMA与FDA在亚硝胺杂质监管方面的差异之前,我们首先回顾亚硝胺杂质的基本概念及研究重点,以更好地理解相关监管背景。

FDA与EMA关于亚硝胺杂质规定的主要区别
FDA和EMA在控制药品中亚硝胺杂质方面,虽然在保障药品的安全性和有效性的目标一致,但在政策适用范围、分类、根源分析及控制策略上存在一定差异和共性。以下是两者在亚硝胺杂质控制方面的详细对比:

FDA通常对亚硝胺杂质的种类识别更为详尽,定期修订其相关指导原则,而EMA则更注重基于整体风险的监管方法。尽管两者在监管策略上有所不同,但均强调对亚硝胺杂质的严格控制,以确保药品的质量和安全性。
这种差异化监管也反映在最新政策更新中。特别是FDA近期针对特定药物的监管细化,是其持续完善药品安全监管体系的举措之一。
FDA最新动态:道古霉素(Dalbavancin)相关亚硝胺杂质更新
2025年3月28日,FDA发布了《关于亚硝胺杂质可接受摄入量限值》的第18次修订版(Revision 18),进一步强化了对药品中亚硝胺杂质的监管。其中一项重要更新是首次将9种与道古霉素(达巴万星,Dalbavancin)相关的亚硝胺衍生物(Nitrosamine Drug Substance-Related Impurities,NDSRIs)纳入表1(Table 1),并明确其可接受摄入限值为1500 ng/天(依据其遗传毒性,归类为第4类)。
道古霉素作为一种长效抗生素,主要用于治疗急性细菌性皮肤和皮肤结构感染(ABSSSI)。由于其结构中含有二甲基氨基侧链,被FDA评估认为属于高风险体系,因此有必要识别并控制其可能产生的多种N-亚硝基杂质。
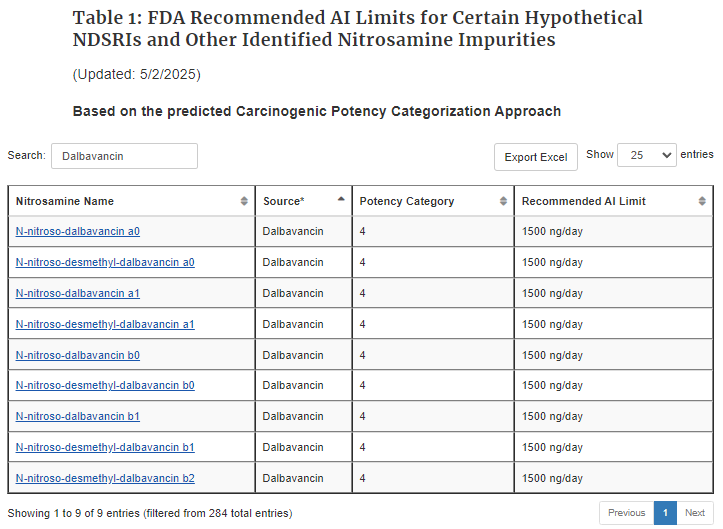
此次更新对其原料药和制剂生产企业提出了更高的质量控制要求。企业需评估生产工艺、建立9种NDSRIs的检测方法,并确保产品符合摄入限值要求。
针对道古霉素特定亚硝胺衍生物(NDSRIs)采取的明确限值措施,正是FDA在“亚硝胺危机”背景下,对潜在NDSRI进行风险管理的重要举措。