痤疮治疗的“First-in-Class”革命
克拉司酮(Clascoterone)是近40年来首个获批用于治疗痤疮的新机制药物。作为一种外用雄激素受体抑制剂,它直接作用于皮肤靶点,避免了全身性抗雄激素的副作用。
这一突破性机制使其成为皮肤科药物研发的热门品种。然而,作为甾体类化合物,其复杂的母核结构给质量控制带来了不小的挑战。
作为40年来首个痤疮治疗新机制药物,克拉司酮(Winlevi)在美国上市即成爆款,三生制药已拿下国内权益。面对国内过亿的痤疮患者及潜在的脱发治疗市场,克拉司酮已成为国内仿制药企争相布局的‘黄金赛道’。
克拉司酮(Clascoterone)市场表现
1. 全球市场表现
商品名与上市情况:
原研药商品名为 Winlevi(1%乳膏),由意大利制药公司 Cosmo Pharmaceuticals 开发。
2020年8月获美国FDA批准,是近40年来首个获批用于治疗痤疮的新机制药物(与传统抗生素或维A酸类不同)。
2021年11月在美国正式上市,由仿制药巨头 Sun Pharma(太阳制药) 负责商业化。
销售数据:
上市初期表现强劲,被称为美国皮肤科市场过去15年来发布最成功的痤疮药物。
据Sun Pharma财报及IQVIA数据,截至2023年,Winlevi在上市后的短时间内处方量迅速攀升,并在美国品牌痤疮药物市场占据了显著份额(部分数据显示其在品牌药新处方中占比极高)。
潜力预测: 分析师预测Winlevi的销售峰值有望超过2亿美元,若脱发适应症(Breezula)获批,市场空间将成倍增长。
2. 中国市场格局
2023年7月,三生制药(3SBio) 与Cosmo签署独家许可协议,获得了克拉司酮(Winlevi)在大中华区(中国大陆、港澳台)的开发和商业化权利。目前处于临床申请/推进阶段。
国内仿制药研发热度(抢仿态势):
热门标的: 由于克拉司酮机制新颖且市场需求巨大(颜值经济),国内多家致力于皮肤科药物的药企和CRO已将其列为重点研发项目。
API备案: 根据CDE(国家药监局药品审评中心)登记平台及相关化工网数据,国内已有部分原料药企业开始布局克拉司酮API的研发和小试/中试生产,杂质对照品的需求正处于爆发前夜。
专利挑战: 原研相关化合物专利在国内的布局和有效期是仿制药企业关注的焦点,这也对药学研究中的规避设计和杂质控制提出了更高要求。
甾体药物的特殊性与质控要点
克拉司酮属于皮质类固醇的衍生物(17α-丙酸皮质醇酮)。甾体药物通常具有多晶型、难溶于水以及结构相近杂质多等特点。
剂型因素: 克拉司酮多为乳膏制剂。在半固体由于基质复杂,辅料与主药、辅料与杂质之间的相互作用研究(相容性研究)尤为关键。
杂质溯源与风险控制
在克拉司酮的申报资料中,杂质谱分析是CDE关注的重点:
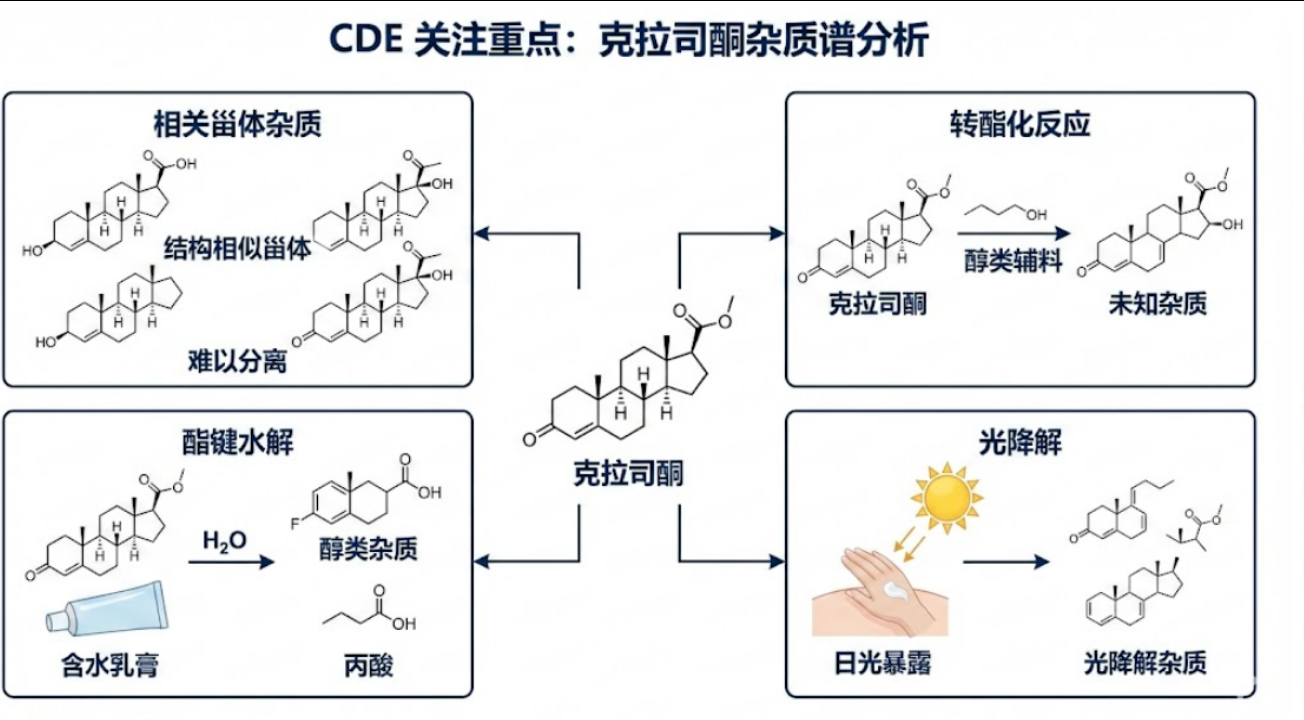
相关甾体杂质: 合成起始物料(如皮质醇酮)及中间体中可能残留结构极其相似的甾体化合物(如不同位置的羟基化或双键异构体)。这些杂质由于骨架相同,在常规C18柱上极难分离。
酯键水解: 克拉司酮分子中含有丙酸酯键,在乳膏制剂含水且长期储存的情况下,极易发生水解生成醇类杂质和丙酸。
转酯化反应: 如果处方中含有醇类辅料,酯基可能发生转酯化反应,生成新的未知杂质。
光降解: 局部外用药在涂抹后可能暴露于日光下,光稳定性研究及光降解杂质的定性是必做项目。
CATO提供克拉司酮杂质标准品
上一篇:CATO优势现货 | 他达拉非“双亚硝基”杂质助力药研
下一篇:没有了