近期,CDE的一系列审评结论,给火热的比拉斯汀研发潮兜头浇了一盆冷水。据本台独家梳理的数据显示,仅在2025年第四季度,就有包括扬子江、山东鲁抗、江苏联环等多家知名药企的比拉斯汀片仿制药申请(4类)遭遇“不批准”。
究竟是什么原因导致了这场集体性的“翻车”?随着业内信息的抽丝剥茧,所有的矛头似乎都指向了同一个方向——上游原料药,尤其是印度来源的原料药质量与合规性危机。
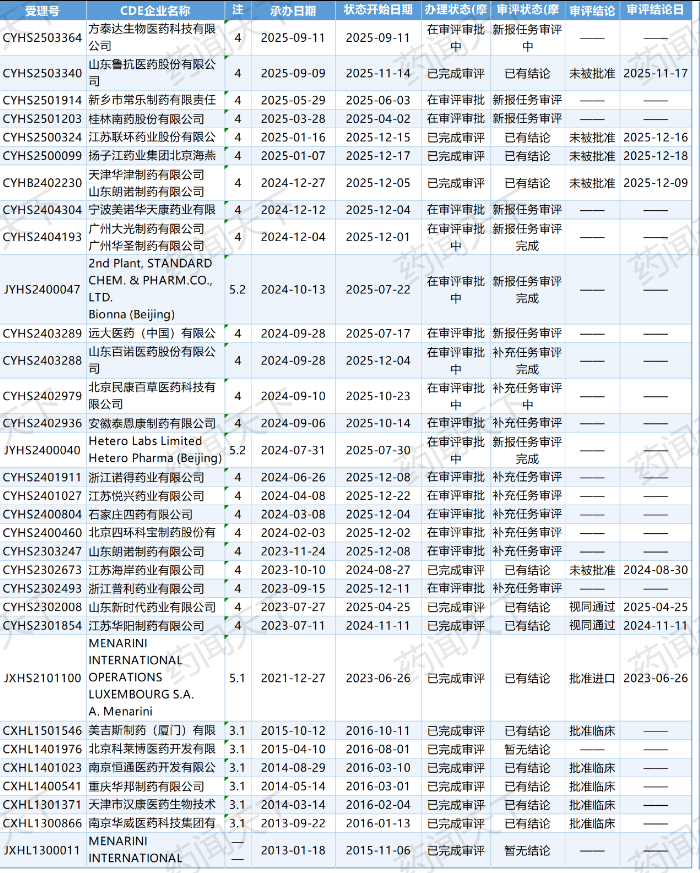
让我们先看一组真实的数据。
根据CDE最新公示(截至2025年12月22日),比拉斯汀片的审评状态出现了一波密集的“红灯潮”:
2025年11月17日,山东鲁抗医药与浙江莎普爱思联合申报的项目(受理号 CYHS2503340)结论为“未被批准”。
2025年11月20日,扬子江药业集团北京海燕药业的项目(受理号 CYHS2500099)结论为“未被批准”。
2025年12月16日,江苏联环药业的项目(受理号 CYHS2500324)同样收到了“未被批准”的通知。
2025年12月5日,天津华津制药有限公司与山东朗诺制药有限公司(受理号CYHB2402230)结论为未被批准。
短短两个月内,4家实力雄厚的企业接连折戟。如果再往前追溯,还有更多企业处于漫长的“补充任务审评”或“暂停”状态。数据显示,目前仍有大量受理号(如CYHS2400040,Hetero Labs相关)处于审评审批的胶着阶段。
这在仿制药审评中并不常见。通常情况下,知名大药厂的制剂研发能力是非常成熟的,出现如此集中、高频率的“不批准”,大概率不是制剂工艺本身的个案问题,而是出现了系统性的共性缺陷。
一位不愿具名的资深注册总监向我们透露:“比拉斯汀这个品种,晶型极难控制,且杂质谱复杂。但这波拒批的核心原因,恐怕更在于原料药关联审评的‘暴雷’。”
比拉斯汀的这场“拒批潮”,给整个医药行业上了一堂昂贵的风险管理课。
首先,单纯的“拿来主义”已经行不通了。
过去那种“买现成进口原料+简单制剂加工”的快消式仿制模式,在当前的监管环境下风险极高。CDE现在的审评逻辑是“全生命周期管理”,对原料药的合成路线、杂质溯源要求极深。如果国内药企对上游供应商缺乏实质性的审计能力和掌控力,盲目依赖进口低价原料,最终只能是给海外供应商的合规漏洞“买单”。
其次,供应链的“备份”至关重要。
很多项目为了抢进度(First-to-file),往往采取单一家原料药供应商策略。一旦该供应商出现483警告信、进口禁令或注册资料缺陷,整个项目就会陷入瘫痪。未来,“双供应商”策略(尤其是“一中一外”或“双国产优质”)将成为高风险品种的标配。
最后,国产原料药的替代机会正在来临。
虽然印度API在价格上有优势,但国内头部原料药企业在合规性、响应速度和定制化服务上正在反超。对于比拉斯汀这种高技术壁垒品种,与其在海外供应链的黑箱中赌运气,不如与国内拥有独立知识产权、晶型专利突破的原料药厂深度绑定。
比拉斯汀的后续审评形势依然严峻。据预测,随着CDE对该品种原料药缺陷核查的深入,未来几个月可能还会看到更多基于同样原因的“不批准”结论。 对于正在排队的企业来说,现在最紧迫的任务不是催进度,而是立刻开展原料药供应商的穿透式审计,甚至做好更换供应商并重新开展BE(生物等效性试验)的最坏打算。 医药研发没有捷径,任何试图在质量源头上“偷懒”的行为,最终都会以更高昂的时间成本来偿还。
行业内广泛流传的消息是,这波被拒的企业中,相当一部分采用了来自印度的原料药供应商。 为什么是印度?原因很简单:成本与成熟度。印度作为“世界药房”,在比拉斯汀原料药上起步早、产能大、价格极具诱惑力。对于试图在集采中通过价格战胜出的国内仿制药企来说,选择印度API似乎是顺理成章的“降本”首选。 然而,成也萧何,败也萧何。 1. 数据完整性与GMP合规的“老毛病” 从我们掌握的数据中可以看到,印度仿制药巨头Hetero Labs(海得拉巴)的相关受理号(CYHS2400040)目前虽显示“新报任务审评完成”,但整个审评周期被显著拉长。 近年来,FDA和欧盟对印度药企的飞行检查中,屡次发现数据完整性(Data Integrity)问题、交叉污染风险以及杂质控制不达标。CDE在推进国际化标准接轨的过程中,对进口原料药的核查力度已今非昔比。一旦源头工厂的GMP状态存疑,或者在注册核查中无法提供可追溯的原始数据,下游关联的所有制剂厂家都会被“连坐”。 2. 致命的“杂质谱”与晶型专利 “比拉斯汀对比了多家印度货,普遍存在未知杂质超标的风险。”一位药物分析专家指出。比拉斯汀属于两性离子化合物,溶解度和渗透性受pH影响大,且存在多晶型问题。 部分印度供应商为了绕开原研晶型专利,采用了不稳定的亚稳态晶型,导致制剂在稳定性考察期间发生转晶,溶出曲线崩盘。更严重的是,近期CDE对亚硝胺类基因毒性杂质的管控极度严苛,而部分印度供应商在合成路线中使用的试剂(如亚硝酸钠)残留管控不足,直接导致原料药在毒理评估上“一票否决”。 此外,近年来,印度仿制药巨头(如Hetero Labs、Aurobindo等)多次因亚硝胺杂质(NDMA等)超标被FDA和EMA勒令召回或警告。 虽然这些新闻多集中在沙坦类、雷尼替丁等品种,但Hetero Labs正是比拉斯汀全球主要的原料药供应商之一。这种“有前科”的供应商背景,使得CDE在审评其关联的比拉斯汀制剂时,对其亚硝胺风险的核查会由于“习惯性违规”而升级为最高级别。 作为一个早在国际上市的品种,Hetero 自己的进口注册(5.2类)目前仍在审评胶着期,且经历了“新报任务审评完成”后的漫长等待。这暗示了监管层对其核心资料也许还存在疑问,很可能正在进行严苛的发补或排队等待现场核查。连“本尊”都还没通关,下游引用的仿制药企自然只能拿到“不批准”或无休止的等待。 声明:以上内容来源网络,如信息有误、需删除或有其他任何疑问,请联系tianwen.zhan@cato-chem.com立刻处理。