恩扎卢胺(Enzalutamide)作为第二代非甾体雄激素受体(AR)抑制剂,是治疗转移性去势抵抗性前列腺癌(mCRPC)的重要药物。其作用机制包括:竞争性抑制雄激素与受体结合、阻断AR核转位,以及抑制AR与DNA的相互作用,从而诱导肿瘤细胞凋亡。
与第一代药物如比卡鲁胺相比,恩扎卢胺对AR的亲和力提高5-8倍,且无激动剂活性,代表了前列腺癌治疗的重要进步。
然而,恩扎卢胺独特的化学结构和复杂的体内代谢途径(主要经CYP2C8和CYP3A4代谢,其中CYP2C8负责生成主要活性代谢物N-去甲基恩扎卢胺),使得原料药及制剂的杂质控制要求极为严格。为了满足美国药典(USP)及ICH Q3A/Q3B指南的限度规定,深入理解其稳定性和建立精准的分析方法至关重要。
恩扎卢胺的化学稳定性与降解机理
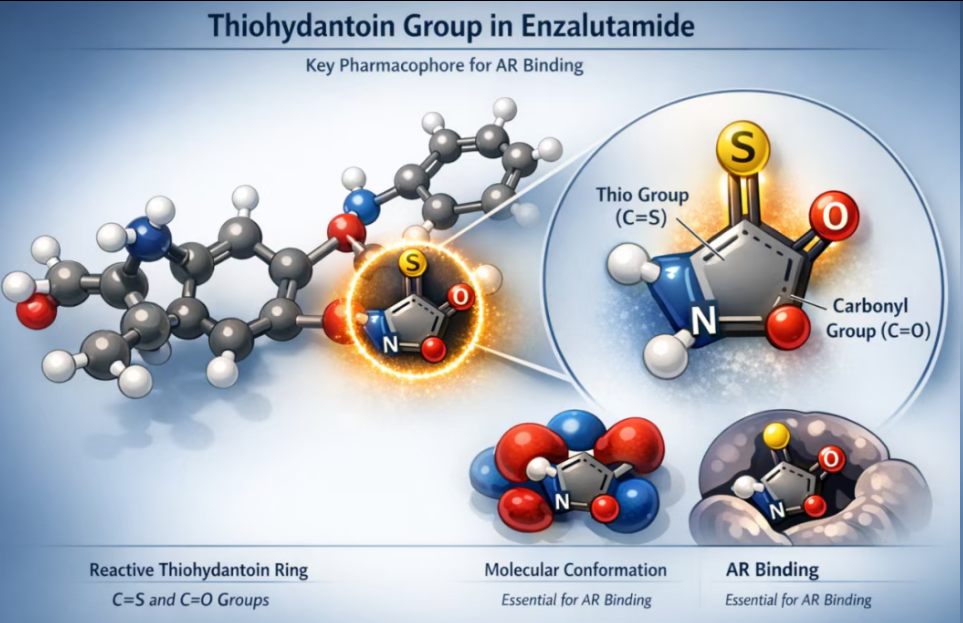
恩扎卢胺分子结构中的硫代乙内酰脲(Thiohydantoin)环是其发挥药效的关键药效团。这一五元杂环含有一个硫羰基(C=S)和一个羰基(C=O),使分子具有特定的空间构象和电子分布,这对AR结合至关重要,但同时也带来了稳定性的挑战。
1、化学稳定性挑战
硫代乙内酰脲环虽然具有一定的刚性和疏水性,但在以下条件下较为敏感:
碱性环境(pH > 9): 极易发生降解。
湿热条件: 长时间暴露可加速开环。
强氧化环境: 硫羰基易被氧化。
2、关键降解途径
从物理有机化学角度分析,环上的羰基碳连接两个吸电子的氮原子,表现出一定的亲电性。在碱性或潮湿环境中,亲核试剂(如OH⁻、H₂O)可进攻羰基碳,形成四面体中间体,随后可能导致C-N键断裂,五元环开环形成链状羧酸衍生物。
最新研究指引(2025): 最新的稳定性数据显示,恩扎卢胺在常规储存条件下总体稳定,但对水解呈现轻度敏感性。粉末形式的压力测试未见明显降解,表明只要通过适当的储存控制和包装保护,其质量是完全可控的。
主要杂质类型
根据合成路线和降解途径分析,恩扎卢胺的主要杂质包括:
工艺杂质:
异硫氰酸酯类起始原料残留
中间体及其衍生物
环化反应副产物
降解杂质:
羧酸类开环产物
N-去甲基化产物
氧化产物
代谢物:
N-去甲基恩扎卢胺(主要活性代谢物)
羧酸代谢物(经羧酯酶代谢产生)
挑战与策略:分析方法的建立
恩扎卢胺及其相关物质因结构高度相似,在液相分析方法开发中面临巨大分离挑战。
由于分子中含有高疏水性的多苯环骨架及敏感的硫代乙内酰脲结构,常规C18体系往往难以同时解决主峰拖尾和关键杂质对分离度不足的问题。建议在开发中结合正交方法(如LC-MS)辅助确认峰纯度。
色谱分离挑战
恩扎卢胺及其相关物质(如工艺杂质和降解产物)结构高度相似,在HPLC分析中面临以下挑战:
分离难点:
同分异构体分离:某些工艺杂质与主成分仅在侧链上存在细微差异,导致极性非常接近,难以实现有效分离。
峰形控制:分子中的多苯环骨架和硫代乙内酰脲结构可能导致主峰拖尾,影响峰对称性。
关键杂质对分离:需要实现基线分离(分离度 ≥ 1.5),以确保准确量化。

优化的开发策略
针对上述难点,推荐以下开发路径: 色谱柱选择: 苯基己基(Phenyl-Hexyl)柱:利用π-π相互作用增强对芳香化合物的选择性。 五氟苯基(PFP)柱:提供独特的电子相互作用,适合分离极性相似的异构体。 传统C18柱:配合优化流动相体系,作为备选方案。 流动相优化: pH缓冲体系:通常选择pH 4.0-5.0的乙酸铵缓冲液,以维持分子稳定(避免碱性条件导致硫代乙内酰脲降解)。 有机相:乙腈或甲醇,采用梯度或等度洗脱模式。 离子对试剂:必要时添加(如辛烷磺酸钠),以改善极性杂质的保留和峰形。 检测波长: 推荐波长:230-240 nm(基于苯环和氰基的紫外吸收特性,确保高灵敏度)。 严格的方法验证 根据ICH Q2(R1)指南,最终的分析方法必须通过专属性、线性(R² > 0.999)、准确度(回收率98-102%)、精密度及耐用性的全面验证,特别是LOQ需达到0.15%以下,以满足有关物质的控制需求。